华大在线讯(通讯员 朱潇潇)近日,化学学院肖文精教授/陆良秋教授团队在不对称催化合成具有生物活性的杂环领域取得重要进展。相关研究成果发表在美国化学会志(J. Am. Chem. Soc., 2022, 144, 19932)上,我校博士研究生王宝成和清华大学深圳国际研究生院博士后樊婷婷,陆良秋教授和谭英教授为该论文的共同通讯作者。
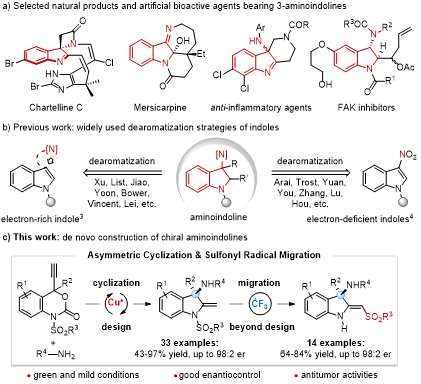
吲哚啉作为基本的结构单元广泛存在于许多具有重要生物活性的生物碱中,同时也是许多合成药物的重要药效单元。由于3-氨基吲哚啉具有显著的生物活性,化学家和药物学家为这类含氮杂环化合物的不对称催化合成提供许多有效方案,并且将这类含氮杂环化合物并用于药物发现研究。目前,发展比较成熟的策略是利用吲哚的不对称去芳构化反应合成这类含氮化合物。相较于该策略,利用不对称催化技术实现手性3-氨基吲哚啉骨架的从头构筑发展滞后。因此,寻找高效的合成策略来直接构筑结构新颖的手性3-氨基吲哚啉具有重要意义,将为发现新的、具有重要生物活性的氮杂环分子奠定物质基础。
陆良秋教授长期致力于过渡金属(Pd, Cu, Ir等)催化的不对称环化反应,成功合成了一系列具有重要生物活性的手性杂环化合物(J. Am. Chem. Soc. 2017, 139, 14707; J. Am. Chem. Soc. 2019, 141, 133; Angew. Chem. Int. Ed. 2020, 59, 14096; Angew. Chem. Int. Ed. 2022, 61, e202117215; Chem. Soc. Rev. 2022, 51, 414等)。在此基础上,他于近期设计了一种直接从头构筑手性3-氨基吲哚啉骨架的简单方案:由铜催化的不对称炔丙基胺化(APA)和炔烃氢胺化构成的串联环化反应。该反应形成的环外烯烃官能团为自由基介导的官能化反应奠定基础,从而最终合成出两类新的手性3-氨基吲哚啉产物。该反应具有较好的底物普适性,不同类型取代的炔基苯并噁嗪酮均能与9-氨基芴、1-萘基甲胺、1萘胺、缺电子苯胺等其它氮亲核试剂反应,普遍以较高的收率(43%-97% yield)和对映选择性(up to 98:2 er)得到3-氨基吲哚啉产物(33个例子)。与此同时,他们团队发现了一个三氟甲基自由基介导的磺酰基迁移反应,能以较好的收率和对映选择性保持的结果得到另一类手性3-氨基吲哚啉类化合物(14个例子:64-84% yield, up to 98:2 er)。作者与清华大学深圳国际研究生院的谭英教授团队合作,通过细胞表型筛选技术对这些3-氨基吲哚啉的体外抗肿瘤活性进行了研究,试验结果表明手性对抗肿瘤活性有显著影响。实验中的初步结果表明,这些氨基吲哚啉化合物具有进一步开发为抗肿瘤候选药物的潜力。
该项研究得到了国家自然科学基金(优秀青年科学基金、面上项目)、高等学校学科创新引智计划(111引智计划)、湖北省自然科学基金和华中师范大学“桂子学者”计划等项目资助。
(审读人:郭彦炳)